The clinical efficacy of fecal microbiota transplantation combined with mesalazine in treatment of ulcerative colitis
Zhu Yanli, Shen Peijun, Meng Lijun, Yang Lu, Kuai Jun, Qin Yongmei
Department of Gastroenterology, The First Affiliated Hospital of Xinxiang Medical University, Xinxiang, Henan, 453100, China
Corresponding author: Qin yongmei
[Abstract] Objective:To investigate the clinical effect of FMT combined with traditional therapeutic methods in treatment of UC. Methods: Sixty-two UC patients were enrolled in Department of Gastroenterology, The First Affiliated Hospital of Xinxiang Medical University between June 2019 and June 2024, and were divided into traditional therapy group (n=37) and FMT+traditional therapy group (n=25). Clinical efficacy was evaluated by comparing the Sutherland Disease Activity Index (DAI) scores before and after treatment and the endoscopic mucosal scores. Results :The total efficiency rate was higher in FMT+traditional therapy group (88.00%) when compared with traditional therapy group (72.97%) (P<0.001). There was no significant difference of incidence of side effects between two groups (24% vs 29.73%, P=0.087). Sutherland disease activity index score was lower in FMT+traditional therapy group when compared with traditional therapy group post treatment (5.16±2.39 vs 6.46±2.16, P=0.030). However, there was no statistical difference of mucosal score between two groups (1.96±0.93 vs 1.65±1.06, P=0.239). Conclusion: FMT combined with traditional therapy significantly improved the clinical efficac.
[Keywords] Fecal microbiota transplantation; Ulcerative colitis; disease activity index
溃疡性结肠炎(ulcerative colitis, UC)是非特异性肠道炎症性疾病,其病因和发病机制尚不明确,可能与感染、免疫、遗传、环境、肠道菌群等多种因素相互作用有关[1]。如今,随着生物医学科学的快速发展, 肠道菌群在炎症性肠病中的关键作用逐渐被揭示。目前治疗UC的药物主要包括氨基水杨酸类药物、糖皮质激素、免疫抑制剂、生物制剂,以及手术治疗等[2]。传统药物治疗对UC的疗效有限,激素及免疫抑制剂副作用较大。近年来的研究表明,肠道菌群的改变与UC的发生发展有着密切的关联,粪菌移植(fecal microbiota transplantation, FMT)在UC治疗中展现出显著的疗效,缓解率约为24%~47%[3-5]。 2014年, Sha及其团队[6] 系统分析了来自12篇共111例炎症性肠病(inflammatory bowel disease, IBD)患者的结果, 这些结果表明FMT对IBD患者临床有效率达78.4%, 其中对成人UC的有效率接近90%; 同年, Colman等人[7]做了类似研究,对119例接受FMT治疗的IBD患者疗效进行分析, 表明FMT对IBD的临床缓解率为45%, 其中UC的临床缓解率为22%, 克罗恩病(Crohn's disease, CD)的临床缓解率为60.5%。免疫因素在UC发病中发挥重要的作用,CD8+T细胞在UC发病中可促进炎症应答[8],白细胞介素-38(interleukin-38, IL-38)主要通过IL-36受体(IL-36 receptor, IL-36R)介导的信号通路在炎症性肠病中发挥抗炎和保护性作用[9],但在UC患者中IL-38对CD8+T细胞的调控功能尚未完全阐明。FMT对UC患者外周血IL-38表达和CD8+T细胞功能的影响罕见相关报道。本研究探讨了FMT联合传统疗法对UC患者的临床疗效改善。
1 资料与方法
1.1 临床资料 以2019年6月至2024年6月期间,新乡医学院第一附属医院消化内科确诊的UC的62例患者作为研究对象,入组标准:(1)根据中华医学会消化病学分会炎症性肠病学组制定的《炎症性肠病诊断与治疗的共识意见(2018年,北京)》[10]中的标准,同时经肠镜检查和病理学诊断,以上62例患者被确诊为UC。(2)年龄>18岁且<65岁。(3)获得知情同意。排除标准:(1)合并病毒性肝炎、人获得性免疫缺陷病毒(human immunodeficiency virus, HIV)等慢性病毒感染;(2)合并心脏、肺、肝脏、肾脏、中枢神经系统等重要脏器功能不全;(3)合并其他自身免疫性疾病;(4)妊娠和哺乳期妇女。按照患者意愿分为传统治疗组(37例)和FMT+传统治疗组(25例)。同时纳入同时期在新乡医学院第一附属医院进行健康查体的志愿者作为对照组(20例)。本研究方案已获医院伦理委员会审批(医学伦理号:2016056),入组志愿者均已签署知情同意书。
1.2 治疗方法
1.2.1 传统治疗组 给予美沙拉嗪肠溶片 1g/次、4次/d治疗,症状缓解12周后逐步减量至0.5g/次、3次/d维持治疗,并嘱患者清淡饮食,避免进食诱发病情加重的食物。观察期为15周。
1.2.2 FMT+传统治疗组 在上述传统治疗基础上,在使用美沙拉嗪肠溶片维持治疗时加用FMT治疗。FMT治疗过程参照本课题组已发表文献进行[11],主要过程如下:(1)粪菌移植供体选择:选择新乡医学院在校健康青年大学生,年龄范围为23至28岁,体质指数(BMI)在18.5至24.0之间。首先通过问卷调查的形式对供体进行初步筛选(主要包括:是否有病毒性肝炎、艾滋病等传染性疾病、是否曾经使用违禁药物、是否罹患肠道菌群紊乱相关疾病、是否罹患自身免疫性疾病、是否罹患慢性便秘或慢性腹泻、近6个月是否前往传染病疫区、近3个月是否应用抗生素、既往是否曾使用免疫抑制剂),然后在新乡医学院第一附属医院行血尿粪常规、乙肝五项、抗丙型肝炎抗体、抗HIV抗体、梅毒抗体检测,符合纳入标准的志愿者进行粪便采集。(2)菌液制备:清晨采集未被污染的供体新鲜粪便50g,留置于无菌密封容器中,迅速送至粪菌分离室。然后将1000 ml无菌生理盐水加入容器,使粪便溶解并充分混合均匀,通过标准化粪菌智能分离系统(湖南海路生物科技有限公司)对粪便溶液进行搅拌、过滤、离心处理,整个过程需在2小时内完成。粪便菌液现用现制备,剩余菌液需在-80℃条件下冻存,若使用冻存菌液,需将菌液于37 ℃水浴解冻1~2 小时后使用。(3)粪菌移植方法:患者采用左侧卧位,头高脚低,将胃镜前端送至十二指肠降段,经活检孔插入直径约2 mm的无菌注射管,用50 ml注射器缓慢注入150 ml粪菌。观察期为15周。
1.3 临床疗效评价和不良反应
1.3.1 Sutherland疾病活动指数(disease activity index, DAI) 评价项目包括:腹泻、出血、黏膜表现、医师评估病情。每项指标计分为0~3分,腹泻(0分:正常;1分:超过正常1-2次/d;2分:超过正常3-4次/d;3分:超过正常>5次/d),出血(0分:无;1分:少许;2分:明显;3分:以血为主),黏膜表现(0分:正常;1分:轻度易脆;2分:中度易脆;3分:重度易脆伴渗出);医师评估病情(0分:正常;1分:轻;2分:中;3分:重)。Sutherland DAI总分为各项之和。≤2分为症状缓解,3-5分为轻度活动,6-10分为中度活动,11-12分为重度活动。
1.3.2 肠镜下黏膜评分标准 0分:肠黏膜正常;1分:黏膜充血、血管模糊;2分:黏膜接触性出血;3分:黏膜自发性出血;4分:黏膜溃疡形成。
1.3.3 不良反应 观察并记录患者在粪菌移植后是否出现诸如腹痛、腹泻、腹胀、恶心、纳差、发热、头晕、皮疹等症状。
1.4 统计学分析 使用SPSS23.0软件进行统计学分析。所有计量资料采用Shapiro-Wilk检验进行正态性分析,结果均符合正态分布,采用均数±标准差表示,两组间比较采用独立样本t检验或配对t检验,多组之间比较首先采用单因素方差分析,多组之间两两比较采用SNK-q检验。计数资料采用卡方检验。若P<0.05,则认为差异具有统计学意义。
2 结果
2.1 入组志愿者临床资料 本研究共纳入62例UC患者,其中,37例接受美沙拉嗪传统治疗,25例接受FMT+美沙拉嗪治疗,入组志愿者的临床资料见表1。美沙拉嗪传统治疗组和FMT+美沙拉嗪治疗组中,Sutherland DAI评分和黏膜评分在治疗前的差异无统计学意义(χ2=0.665,P=0.086)。
表1 入组志愿者的临床资料
Table 1 Clinical characteristics of enrolled volunteers
项目 | 传统治疗组 | FMT+传统治疗组 |
病例数 (n) | 37 | 25 |
性别 (男/女) | 22/15 | 14/11 |
年龄 (岁) | 43.97±9.36 | 47.92±10.38 |
Sutherland DAI评分 | 7.46±2.02 | 7.84±2.12 |
粘膜评分 | 2.62±0.92 | 2.96±1.02 |
病变范围 | ||
直肠 (n, %) | 8 (21.62%) | 5 (20.00%) |
左半结肠 (n, %) | 11 (29.73%) | 9 (36.00%) |
全结肠 (n, %) | 18 (48.65%) | 11 (44.00%) |
2.2 入组志愿者临床疗效、不良反应分析 所有患者均完成了15周的治疗观察期,美沙拉嗪传统治疗组中,22例临床缓解、5例有效、10例无效,总有效率为72.97%,FMT+美沙拉嗪治疗组中,17例临床缓解、5例有效、3例无效,总有效率88.00%,显著高于美沙拉嗪传统治疗组(χ2=4.17,P<0.001)。美沙拉嗪传统治疗组和FMT+美沙拉嗪治疗组中,Sutherland DAI评分和黏膜评分在治疗后均显著低于基线(P<0.05,图1A和图1B)。治疗后,FMT+美沙拉嗪治疗组Sutherland DAI评分显著低于传统治疗组(5.16±2.39比6.46±2.16,t=2.228,P=0.030,图1A),但治疗后黏膜评分在FMT+美沙拉嗪治疗组和美沙拉嗪传统治疗组之间的差异无统计学意义(1.96±0.93比1.65±1.06,t=1.189,P=0.239,图1B)。美沙拉嗪传统治疗组11例发生不良反应(腹泻3例、腹胀2例、腹痛2例、恶心1例、头晕1例、纳差1例、发热1例),不良反应发生率为29.73%,FMT+美沙拉嗪治疗组6例发生不良反应(发热2例、腹胀1例、恶心2例、纳差1例),不良反应发生率为24%。因P>0.05,两组不良反应发生率的差异无统计学意义(χ2=0.673,P=0.087)。见表2。
表2 入组志愿者的临床疗效和不良反应
Table 2 Clinical efficacy of enrolled volunteers
项目 | 传统治疗组 | FMT+传统治疗组 | P值 |
病例数 (n) | 37 | 25 | |
治疗前Sutherland DAI 评分 | 7.46±2.02 | 7.84±2.12 | (P>0.05) |
治疗后Sutherland DAI 评分 | 6.46±2.16 | 5.16±2.39 | (P<0.05) |
治疗前黏膜评分 | 2.62±0.92 | 2.96±1.02 | (P>0.05) |
治疗后黏膜评分 | 1.65±1.06 | 1.96±0.93 | (P>0.05) |
不良反应发生率 | 29.73% | 24% | (P>0.05) |
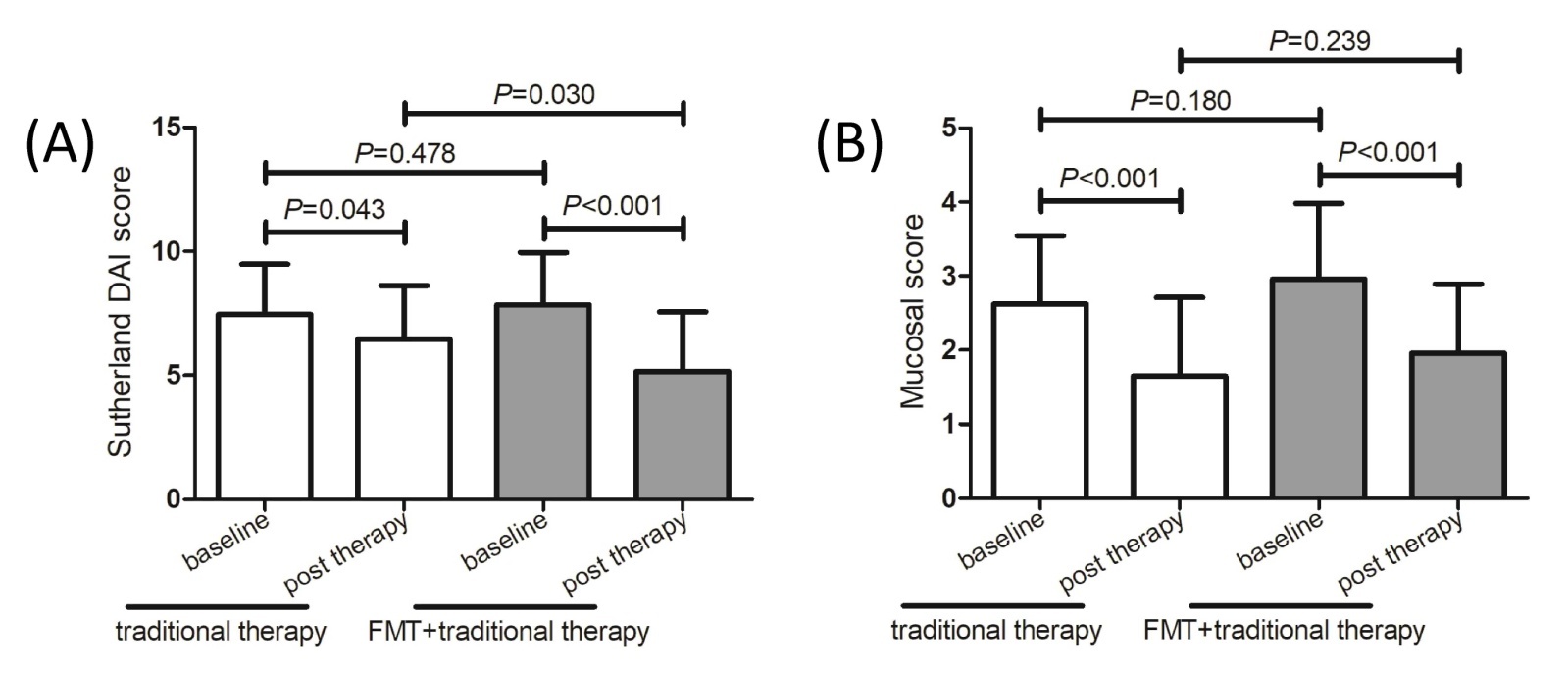
A: Sutherland DAI score; B: Mucosal score
图1 美沙拉嗪传统治疗组和FMT+美沙拉嗪治疗组治疗前后Sutherland DAI评分和黏膜评分的比较
Figure 1 Comparison of Sutherland disease activity index (DAI) score and mucosal score between baseline and post therapy in traditional therapy group and FMT+traditional therapy group
3 讨论
溃疡性结肠炎和克罗恩病同属于炎症性肠病,迄今尚不明确其病因及发病机制,可能与遗传、感染、免疫、环境、肠道菌群等多种因素有关[1]。目前已知的人体肠道菌群的细菌数量约为100万亿个, 是成年人体细胞总数的10倍, 重量1.0-1.5 kg, 其宏基因是人类基因的100倍, 种类约1000种, 然而,目前人类仅能识别其中约三分之一的菌群种类,能够成功培养的更是寥寥无几,因此肠道菌群又被称为尚未被认识的人体第八大器官。因肠道菌群失调导致的疾病也是种类繁多。粪菌移植可增加肠道细菌丰度, 优化肠道菌群谱, 从而多方面影响机体。
UC患者肠道黏膜屏障遭到破坏,免疫系统异常激活,促炎免疫细胞和细胞因子水平升高,保护性细胞因子水平降低,促进UC疾病进程。在这一过程中,异常免疫活化也可造成肠道菌群失调,肠道菌群失调亦参与了UC的发病[12]。FMT治疗可重塑肠道菌群平衡,增加厚壁菌门相对数量,降低拟杆菌门和变形菌门数量,主要表现为FMT治疗后乳杆菌属、丁酸球菌属、乳酸杆菌属、欧陆森氏菌属、气味杆菌属等益生菌属的相对丰度上调,但幽门螺杆菌属、拟杆菌属、梭菌属等致病菌的相对含量降低[13]。FMT在UC的治疗中亦取得了较好的临床疗效。本研究发现,FMT+传统治疗后,UC患者Sutherland DAI评分和黏膜评分较单纯传统治疗后显著降低,总体有效率亦高于传统治疗,说明抑制的肠道可能增强了传统治疗的临床疗效,促进肠道黏膜修复。但FMT是否发挥了免疫调控作用需要进一步研究。
对于IBD相关的分子机制,有研究表明IL-38发挥重要作用,IL-38属于IL-1细胞因子家族成员,可由免疫细胞和上皮细胞分泌,通过IL-36R介导的信号通路发挥免疫调控作用。在活动性炎症性肠病(inflammatory bowel disease, IBD)中,肠道上皮组织中免疫细胞和非免疫细胞中IL-38的表达水平显著升高[14],B细胞是IBD患者和葡聚糖硫酸钠(dextran sulfate sodium, DSS)诱导的IBD小鼠模型肠道中IL-38的主要来源[15]。在DSS诱导的IBD小鼠模型中,IL-38基因敲除可导致IBD肠道病变程度加重、体重进一步减轻、肠道渗透性增加、结肠上皮内中性粒细胞浸润显著增多[16],这说明IL-38在IBD中主要发挥抗炎和保护性作用[9]。
另外,CD8+T细胞亦参与了UC的发病过程。UC相关的CD8+效应性T细胞可促进组织损伤,诱导强烈的免疫炎症损伤,造成肠道黏膜损伤[17]。CD8+T细胞主要通过以下两种途径发挥细胞毒性功能:一方面,CD8+T细胞可分泌穿孔素、颗粒酶B和颗粒溶素,通过穿孔素/颗粒酶B或颗粒溶素这一经典细胞杀伤途径介导靶细胞坏死和凋亡,造成组织损伤,这一过程依赖CD8+T细胞与靶细胞的直接接触[18-19]。另一方面,CD8+T细胞可表达TRAIL和FasL等TNF家族促凋亡成员,可分别与其受体结合,形成死亡诱导信号复合体,启动下游Caspase级联反应,诱导促凋亡物质表达,最终引发细胞凋亡[20-21]。新近的研究发现,以PD-1和CTLA-4为代表的免疫检查点分子可抑制CD8+T细胞的功能活性[22-23]。上述结果提示,FMT可能主要通过抑制CD8+T细胞分泌毒性分子分泌调控UC患者CD8+T细胞功能活性。
总之,FMT联合传统治疗可显著提高UC患者临床疗效。本文的不足之处,是未对其分子机制进一步深入研究。据上面相应文献所述,IL-38可作为UC治疗的潜在靶点之一,用于临床治疗药物的研发。
参考文献
[1] Segal JP, Leblanc JF, Hart AL. Ulcerative colitis: an update [J]. Clin Med (Lond), 2021, 21(2): 135-139.
[2] Hirten RP, Sands BE. New therapeutics for ulcerative colitis [J]. Annu Rev Med, 2021, 72: 199-213.
[3] Shen ZH, Zhu CX, Quan YS, et al. Relationship between intestinal microbiota and ulcerative colitis: Mechanisms and clinical application of probiotics and fecal microbiota transplantation [J]. World J Gastroenterol, 2018, 24(1): 5-14.
[4] Paramsothy S, Nielsen S, Kamm MA, et al. Specific bacteria and metabolites associated with response to fecal microbiota transplantation in patients with ulcerative colitis [J]. Gastroenterology, 2019, 156(5): 1440-1454.e2.
[5] Matsuoka K. Fecal microbiota transplantation for ulcerative colitis [J]. Immunol Med, 2021, 44(1): 30-34.
[6] Sha S, Liang J, Chen M, Xu B, Liang C, Wei N, Wu K. Systematic review: faecal microbiota transplantation therapy for digestive and nondigestive disorders in adults and children. Aliment Pharmacol Ther 2014; 39: 1003-1032 [PMID:24641570 DOI: 10.1111/apt.12699]
[7] Colman R J, Rubin D T. Fecalm icrobiota transplantation as therapy for inflammatory bowel disease: a systematic review and meta analysis. J Crohns Colitis 2014; 8: 1569-1581 [PMID: 25223604 DOI: 10.1016/j.crohns.2014.08.006]
[8] Casalegno Garduño R, Däbritz J. New insights on CD8+ T cells in inflammatory bowel disease and therapeutic approaches [J]. Front Immunol, 2021, 12: 738762.
[9] Ohno M, Imai T, Chatani M, et al. The anti-inflammatory and protective role of interleukin-38 in inflammatory bowel disease [J]. J Clin Biochem Nutr, 2022, 70(1): 64-71.
[10] 中华医学会消化病学分会炎症性肠病学组. 炎症性肠病诊断与治疗的共识意见(2018年,北京) [J]. 中华消化杂志, 2018, 38(5): 292-311.
[11] 周从顺, 韩宇, 张彩凤, 等. 粪菌移植联合传统药物治疗溃疡性结肠炎对临床疗效及对血清学指标的影响 [J]. 中国微生态学杂志, 2022, 34(3): 327-337.
[12] Guo XY, Liu XJ, Hao JY. Gut microbiota in ulcerative colitis: insights on pathogenesis and treatment [J]. J Dig Dis, 2020, 21(3): 147-159.
[13] Zhang W, Zou G, Li B, et al. Fecal microbiota transplantation (FMT) alleviates experimental colitis in mice by gut microbiota regulation [J]. J Microbiol Biotechnol, 2020, 30(8): 1132-1141.
[14] Fonseca-Camarillo G, Furuzawa-Carballeda J, Iturriaga-Goyon E, et al. Differential expression of IL-36 family members and IL-38 by immune and nonimmune cells in patients with active inflammatory bowel disease [J]. Biomed Res Int, 2018, 2018: 5140691.
[15] Xie C, Yan W, Quan R, et al. Interleukin-38 is elevated in inflammatory bowel diseases and suppresses intestinal inflammation [J]. Cytokine, 2020, 127: 154963.
[16] de Graaf DM, Wang RX, Amo-Aparicio J, et al. IL-38 gene deletion worsens murine colitis [J]. Front Immunol, 2022, 13: 840719.
[17] Corridoni D, Antanaviciute A, Gupta T, et al. Single-cell atlas of colonic CD8+ T cells in ulcerative colitis [J]. Nat Med, 2020, 26(9): 1480-1490.
[18] Zöphel D, Angenendt A, Kaschek L, et al. Faster cytotoxicity with age: Increased perforin and granzyme levels in cytotoxic CD8+ T cells boost cancer cell elimination [J]. Aging Cell, 2022, 21(8): e13668.





